プラズマローゲンの局在制御因子の同定
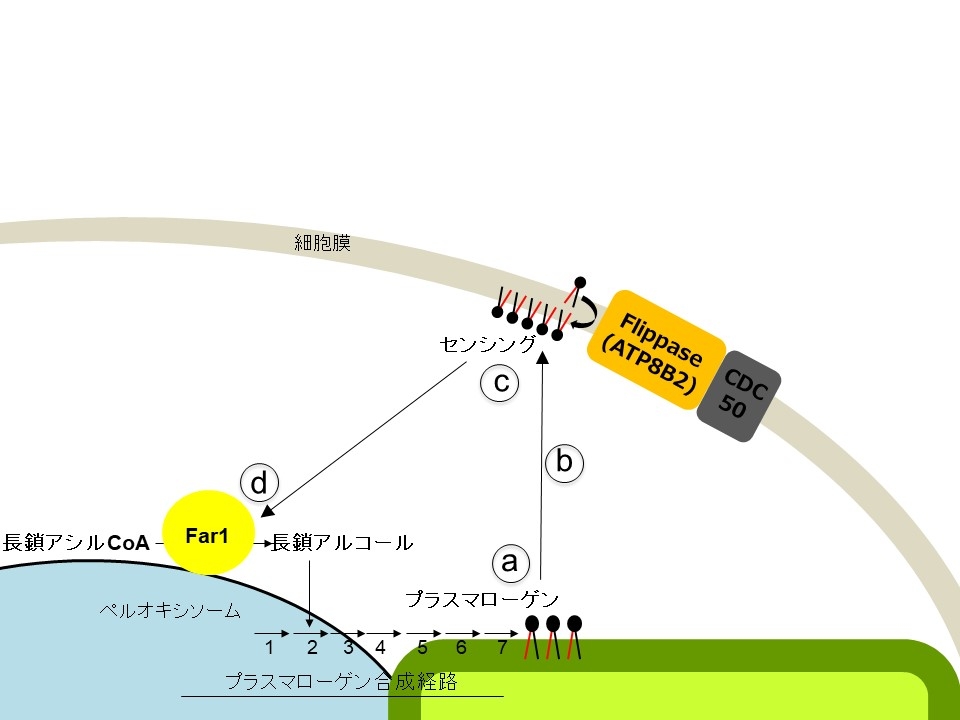
エーテルリン脂質プラスマローゲンは、グリセロール骨格のsn-1位に長鎖アルコールがビニルエーテル結合を介して結合したリン脂質である。プラスマローゲンの生合成は、外層と内層の二重膜で構成される細胞膜の内層に局在するプラスマローゲンが感知され、プラスマローゲン生合成の律速酵素であるfatty acyl-CoA reductase (Far1) の存在量が調節されることで制御される。
今回、私たちはプラスマローゲンの細胞膜内層への局在を担う因子の同定を試みた。プラズマローゲンを含むリン脂質の細胞膜内層への局在化は、フリッパーゼと呼ばれる外層から内層へリン脂質を輸送するタンパク質によってなされる。そこで、細胞膜に局在し、かつ基質特異性の不明な4種のフリッパーゼに着目し、それぞれのフリッパーゼの発現を低下させた細胞におけるプラスマローゲンの分布とFar1のタンパク質レベルを検証した。その結果、ATP8B2の発現抑制でFar1のタンパク質レベルが増加するとともに、プラスマローゲンの細胞膜外葉への局在性の増加も認められた。つまり、ATP8B2の発現抑制は、細胞膜内葉に局在するプラスマローゲンを減少させ、その結果Far1のタンパク質レベルを増加させたと推察されたことからATP8B2はプラスマローゲンのフリッパーゼ機能を有すると結論した。
つぎに、プラスマローゲン欠損細胞では細胞増殖シグナルであるprotein kinase B (PKB/AKT) の細胞膜へのリクルートを介する活性化が抑制されるとの知見に基づき、ATP8B2発現抑制細胞におけるAKTの活性化を調べ、活性型AKTの低下を見出した。
これらの結果から、ATP8B2によって細胞膜内葉に偏在するプラスマローゲンは、プラスマローゲン生合成を制御することに加え、細胞増殖シグナルも制御するとの生理機能が明らかになった。