プラズマローゲンはアルツハイマー病に有効か
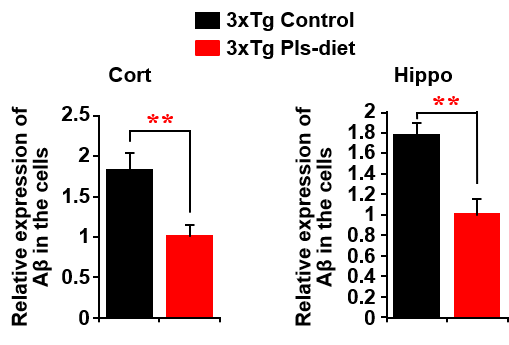
海馬は空間記憶や学習に関わる脳の重要な器官であり、アルツハイマー病では海馬の縮小や炎症が見られることが知られています。さらに1999年、アルツハイマー病患者の海馬ではプラズマローゲン量が減少していることが報告されました。そこで私たちは、この現象の意義を解明するための研究を行いました。
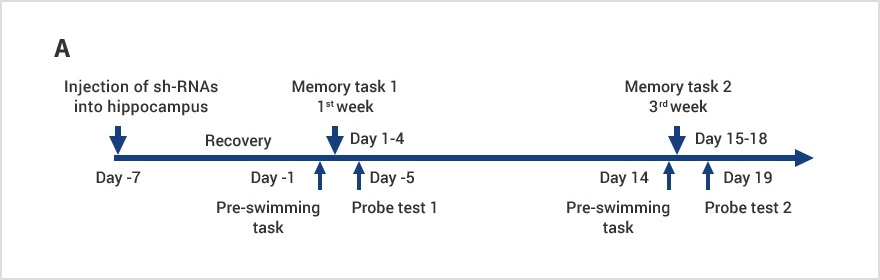
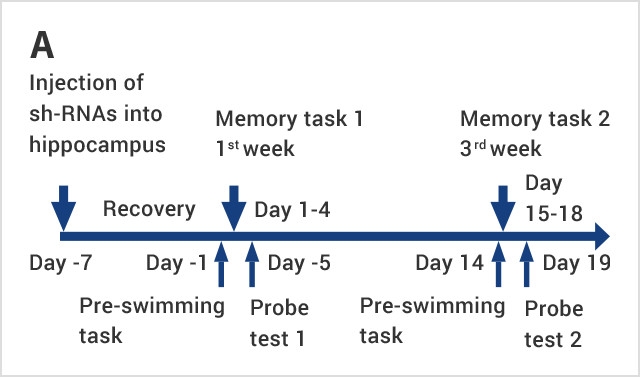
まずは海馬内のプラズマローゲン量を減少させるため、プラズマローゲンの合成酵素であるグリセロホスフェートO-アシルトランスフェラーゼ(GNPAT)の遺伝子を標的とするshort hairpin (sh)-RNAをもつレンチウイルスを作成しました。sh-RNAは標的遺伝子を抑制することができるため、sh-GNPATはGNPATを減少させ、それに伴いプラズマローゲン量も減少するはずです。私たちはこのレンチウイルスをマウスの海馬内に直接注射し、海馬内のプラズマローゲン量減少とともに、空間記憶の障害そして記憶に重要な役割をもつタンパク質である脳由来神経栄養因子(BDNF)の海馬での発現減少が起こることを明らかにしました。sh-GNPATを注射したマウスの海馬内プラズマローゲン量減少は、液体クロマトグラフィー・質量分析(LC-MS)法によって確認しています。
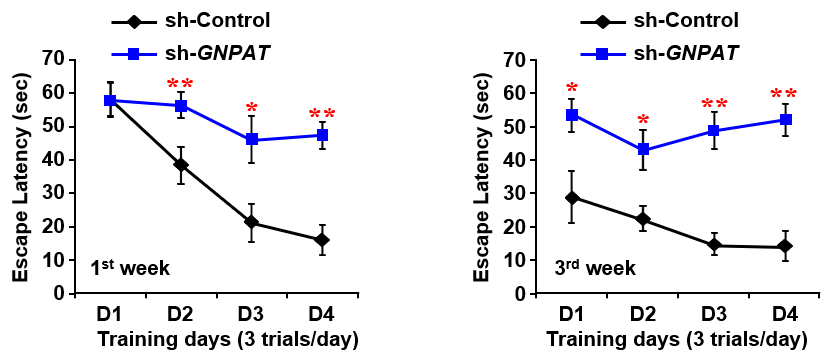
この研究では、マウス海馬にプラズマローゲン含量を減少させるsh-GNPATを送ることができるレンチウイルスを注射した後、モリス水迷路実験を行いました。モリス水迷路実験とは1981年に構築された、齧歯類の海馬依存性学習(空間学習や記憶)をテストするための実験方法です。アルツハイマー病などの神経疾患モデル動物の検証に広く用いられています。多くの場合、水温管理された円形プール内に対象動物からは見えないようにゴール台を設置し、その動物がゴールに泳ぎ着くまでの時間(escape latency)を測定します。
私たちは、レンチウイルス注射から1週間後(memory task 1)と3週間後(memory task 2)にそれぞれ1日3回、4日間水迷路実験を行いました。左の図のように、両方のタスクにおいて、sh-GNPATを持たないレンチウイルスを注射したコントロール群(sh-Control)マウスに比べsh-GNPAT群マウスのゴール到達までの時間が短縮されませんでした。
この結果は、海馬内のプラズマローゲン減少によりマウスの空間記憶障害が起こることを示唆しています。また、コントロール群マウスは、通常のマウスと比較しても大きな変化を示さなかったことから、レンチウイルスの海馬内注射は空間記憶に影響を及ぼさないことも確認しています。